


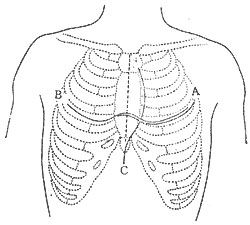
图1 心包切除术常用的三种切口
A.左侧前外切口;B.双侧胸前横切口;C.胸骨正中切口
1.胸骨正中劈开切口 此种手术入路能够充分显示心脏前面及右侧面,易行剥离腔静脉及右心缘部位的增厚心包,术后对呼吸功能影响小。对合并有肺内病变及呼吸功能较差的病例,多采用此切口。其缺点是,左心室膈神经后的心包部分及心尖部分显露较差。有学者认为膈神经后的心包不必切除。
2.左胸前外侧切口 经第五肋间隙进胸,右侧需切断结扎胸廓内动脉并横断胸骨,左侧达腋中线。此种切口的优点是单侧开胸,对呼吸功能的影响小,病人状态较差者可以采用。左心显露好。左室及上、下腔静脉显露较差。
3.双侧胸前横切口 此切口优点是手术野暴露良好,可兼顾心脏左右两侧,能彻底切除心包,术中有意外发生也便于处理。其缺点是切口较长,创伤较大,术后肺功能影响大。
4.经左胸前外侧切口心包剥脱术 病人麻醉后取仰卧位,左肩胛下置一枕垫,左手放在壁下(图2)。沿左侧第五肋间隙,左乳腺下方,作一弧形切口。切开肌肉进胸。胸廓内动脉结扎切断。第五肋软骨靠近胸骨处断开。撑开胸廓显露胸腔。将左膈神经从心包内锐性分离,尽量多带些脂肪及软组织,以免伤及膈神经。在左心室部位切开心包,尽量偏后外侧,选择无钙化区。切口下面有时可见到分层,或有心包积液。但大部分情况下,切开心包即达心肌表面。在心外膜之外找到分层,沿分层进行钝性或锐性剥离并逐渐扩大范围。如增厚的壁层与脏层心包间尚有腔隙,可先切除壁层使心脏搏动初步得到改善,再处理纤维增厚的脏层心包。若心包粘连致密或分层不清,应使用剪刀或刀片进行锐性分离,细致精确地进行解剖。避免强用纯器剥离,以防止心肌创伤及心肌破裂。
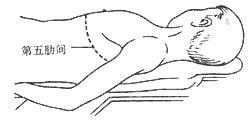
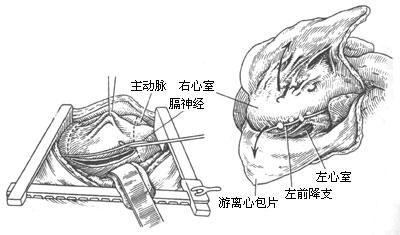
图2 左前外侧切口手术操作示意图
心包剥离的顺序应沿纵行切口的两侧,向右前方及左后方分离。应尽量成片切除,如发生心肌破裂,可利用已剥脱的心包修补止血。右侧的心包片应分离至左侧的房室沟,上界至胸腺的下方。左侧的心包片上界应分离至主肺动脉干,并将其缩窄环切断,以免引起严重的术后右心室压力过高;下界应将膈肌键以外的增厚心包完全游离或切除;后界尽可能将左心室表现的心包完全游离。在分离室间沟部位时,格外注意勿损伤冠状动脉分支,此处如有钙化应给予留置,在其它部位继续剥离。左心房表面的增厚心包对血流动力学影响不大,剥离时较易撕破,止血困难,不需要强行剥离。尽可能切开松解左心房与下腔静脉附近的环形缩窄,房室沟处如存在环形缩窄应予切断。术中应注意先完全剥脱左心室部位的心包,然后剥离右心室流出道,以防发生急性肺水肿。待心包完全剥离之后,再将心包片切除。重症病人心肌萎缩明显。在剥离心包后,心肌表面颜色较淡,剥离范围应适可而止,心室表面及主要缩窄环解除即可。剥离完毕即可应用洋地黄制剂。手术结束时要彻底止血,心包切除边缘用电凝止血。如有必要可在左心耳或肺静脉置放测压管,有利于术后病情观察。安放两根闭式胸腔引流管。
5.经胸骨正中切口心包剥脱术 采用气管内插管全身麻醉。患者取仰卧位,背部肩胛骨区垫高使胸部挺出,胸骨正中劈开。如有胸骨后粘连,应边分离粘连,边用开胸器撑开两侧胸骨。先自心尖部位开始剥离心包。此外心包粘连轻,心包增厚不明显,易于剥离。用刀片逐次划开增厚的心包。增厚的心包与外膜之间常常有一层疏松结缔组织,为正确剥离心包的分界面。切开增厚心包后,可见跳动的心脏向外突出。分离一部分心包后,助手轻轻用钳子提起心包片,术者以左手轻压在心脏表面,可充分显露增厚心包与心肌粘连的程度。如粘连较疏松时,可用手指套纱布或花生米钳予以钝性分离,分离时的用力部位应在心包面上。遇到条索或条带状粘连时,需用剪刀或手术刀片锐性分离。如粘连愈着十分紧密,应放弃原来的分离部位,而在其它位重新切开、分离心包,即先易后难。根据术中病人心功能状态及心包粘连程度决定剥离范围。一般剥离的基本范围:应是心尖部位需完全剥脱;左侧面接近左侧膈神经处;房室沟及下腔静脉入口处的纤维性缩窄环必须松解。剥离的顺序应该是左心室→右心室流出道→房室沟缩窄环→下腔静脉环形束带。
心包机化良好且非常易于剥离者,心包完全剥离最佳。如术中出现心律失常,循环不稳定或心肌颜色发白,心脏扩大,心肌收缩无力,剥离操作需适可而止,主要部位(左、右心室面及下腔静脉缩窄环)剥脱即可。同时应用地高辛及利尿制剂,尽早完全手术,以提高手术安全性。术后必要时给多巴胺等正性肌力药物。
(四)手术并发症及预防措施
1.低心排 在心包剥离过程中,由于急性心脏扩张,特别是右心室表面心包剥除后,在体静脉高压的作用下,心室急剧快速充盈、膨胀,产生急性低心排。因此,术中应限制液体输入,左心室解除缩窄后,立即应用西地兰及速尿,在强心的同时,排队过多液体减轻心脏负担。术后12~48h之内,应用多巴胺等儿茶酚胺类药物。如对药物反应效果较差,低心排不能纠正,可使用主动脉内气囊反搏。
2.膈神经损伤 左前外侧切口在开始心包剥脱之前,Kirklin JW提出应先游离左侧膈神经,尽可能随同膈神经多保留脂肪及软组织。如损伤膈神经,可造成膈肌的矛盾呼吸运动,影响气体交换。不利于呼吸道分泌物的排出。
3.冠状动脉损伤 在分离前室间沟部位时,要格外注意,勿损伤冠状动脉。其分支或末端出血,可缝扎止血。遇到该部位有局限的钙化斑块时,可以留置不予处理,不可勉强切除。
4.心肌破裂 对于嵌入心肌的钙化病灶,一般可岛形保留,不可勉强剥除。对于剥离界限不清,严重粘连时,可将增厚的心包作“井”字切开,部分地解除心肌表面束缚。万一发生心肌破裂时,术者用左手食指平压在裂口上,利用游离的心包片缝盖在破裂口的周围,可挽救病人的生命。
(五)手术后处理
1.一般处理 常规吸氧,密切观察血压、呼吸、脉搏、心率及尿量变化。注意保持引流管的通畅,如渗血较多者,可适量输血。
2.预防性应用抗生素 除常规应用抗生素外,对于结核性心包炎,术后半年至1年内正规抗结核药物治疗。
3.强心利尿 术后继续给予利尿药物,减轻钠水潴留,在充分补钾的条件下,给予洋地黄制剂。严格控制液体输入量。
手术效果
1.手术死亡率 近年来有所下降,约4%。McCaughan BC报告术前病人的心功能状态是影响手术死亡率的最重要因素。术前心功能为Ⅰ~Ⅱ级(NYHA)者手术死亡率为0;心功能Ⅲ及Ⅳ级者,手术死亡率分别为10%及46%。术前腹水,周围水肿,心脏内压力及低心脏指数的程度对手术死亡率有一定的影响。
2.晚期生存情况 Kirklin JW报告手术后5年及15年生存率分别为84%与59%。McCaughan BC报告5年、15年及30年生存率分别为84%、71%与52%。影响晚期生存的主要因素仍是术前心功能状态,而与手术入路无明显关系(图3)。
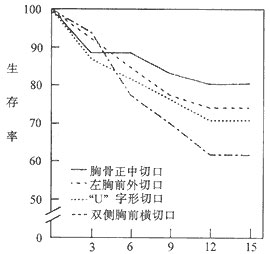
手术后随访时间(年)
图3 心包剥脱术后晚期生存率
此外,Kirklin报告,采用胸骨正中切口及左侧前外侧切口,再手术率仅为2%。
3.术后血流动力学变化 所有病人在安静状态下,心功能的各项血流动力学指标均正常。约10%~20%的病人在体力活动时,出现轻微的肺动脉压力升高,心排量不能代偿性增加。如心室表面增厚心包剥脱不全,则血流动力学不能较好地改善。McCaughan BC报告大部分病人远期效果较好,几乎全部病人都能达到心功Ⅰ~Ⅱ级(图4)。
图4 141例病人术前、术后心功能改变示意图
李法荫等报告缩窄性心包剥脱术132例,手术死亡率为3%。99例随访1~25年,平均8.2年,治愈率73%,症状改善者22%,无明显改善者3%,晚期复发死亡者2%。并提出:心包切除范围,两侧至膈神经前约1cm即可。强调早期手术,病程在1年以内者手术治愈率占80%,病程在1年以上者治愈率仅52%,手术死亡5例中有4例病程超过1年。
慢性缩窄性心包炎通常需要与肝硬化腹水期、心力衰竭、限制性心肌病等疾病鉴别。通常可以通过x线、心电图、超声心电图、心瓣膜杂音、心内膜心肌活检等方式进行鉴别。
慢性缩窄性心包炎是心包纤维增厚、粘连收缩,限制了心室舒张,造成心排量减少、静脉回流受阻的综合征,可能会出现呼吸困难、咳嗽、轻度胸痛、疲劳、乏力、食欲减退等症状。
慢性缩窄性心包炎没有特殊的治疗方法,慢性缩窄性心包炎多见于急性心包炎慢转成慢性炎症,然后心包出现钙化变硬,心脏舒张受到影响,导致静脉回血受阻,出现静脉系统淤血的症状,严重的可以进行心包切除减压术治疗。
主要表现为劳力性呼吸困难、咳嗽、胸痛、乏力、食欲减退等症状。应该到正规的公立医院进行检查,明确诊断,可以采取手术的方法进行治疗,要注意休息,多吃新鲜蔬菜和水果,多喝水。
病情分析: 是由于心包慢性炎症所致心包粘连,增厚或钙化,使心脏舒缩功能受限引起全身循环功能障碍。常见的是结核和化脓性感染。
问题分析:您好,我是外科的医生,根据您的描述考虑可能缩窄性的心包炎,一般保守治疗效果不好
意见建议:手术治疗早期施行心包切除术以避免发展到心源性恶液质、严重肝功能不全、心肌萎缩等。一般手术风险还是可以控制的。
希望我的回答可以帮助您,如果您还有什么疑问,可以随时咨询我。
问题分析:慢性缩窄性心包炎可以吃芦笋
意见建议:原因说明:芦笋富含多种维生素和微量元素具有很高的营养价值和功效,患者平时可以食用,另外患者平时可以多食用富含维生素的蔬菜水果,如苹果西红柿等,平时饮食要均衡清淡少吃动物性油脂及脂肪含量高的食物