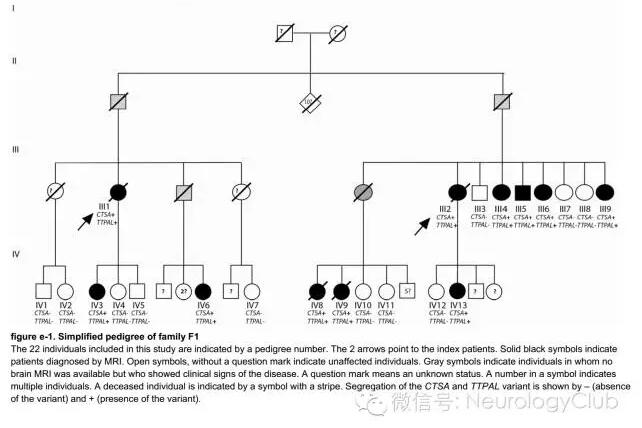
导读:文章原标题:神经综述:一种全新的脑小血管病:伴卒中和白质脑病的组织蛋白酶A相关性动脉病(CARASAL)
概述脑血管疾病在成人中非常普遍,多和年龄、高血压、高脂血症、糖尿病和抽烟等血管性疾病危险因素相关。而在少数患者中,卒中却是由遗传性脑小血管病(small vasculardisease,SVD)引起,包括伴有皮质下梗死和白质脑病的常染色体显性遗传脑动脉病(CADASIL),伴有皮质下梗死和白质脑病的常染色体隐性遗传脑动脉病(CARASIL),HTRA1杂合突变,胶原蛋白IVA1和IVA2缺陷,TREX-1相关性疾病以及遗传性脑淀粉样血管病等。对于一些家族性脑小血管病而言,其致病基因仍不明确。来自荷兰阿姆斯特丹自由大学的Bugiani等学者对2个家系进行了报道,总结了一类显性遗传、成年起病的脑小血管病——伴卒中和白质脑病的组织蛋白酶A相关性动脉病(Cathepsin A-related arteriopathy with strokes and leukoencephalopathy,CARASAL),结果近日发表在Neurology杂志上。CARASAL临床上表现为顽固性高血压、缺血和出血性卒中以及晚期认知功能减退三联征,有相对特征性的MRI和神经病理改变,基因检测提示 CTSA突变。
临床症状与实验室检查
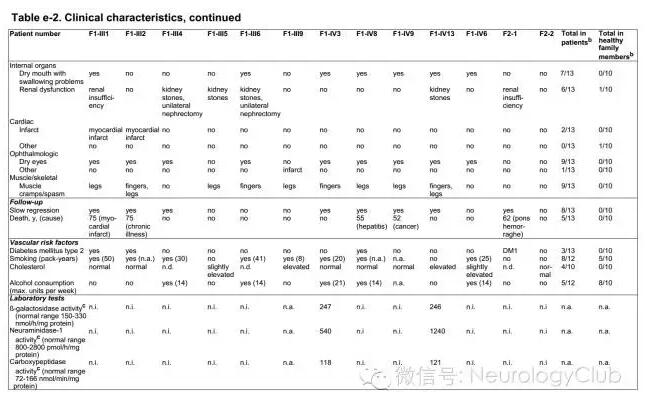
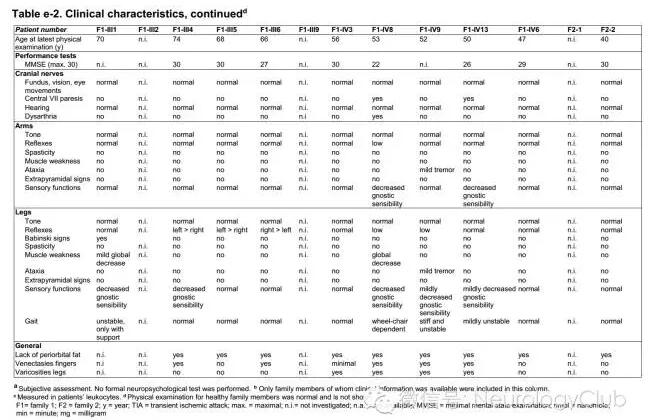
多于30-50岁起病,首发症状有较大异质性,包括头痛、偏头痛、步态异常和脑卒中等。病史多提示血管疾病,如顽固性高血压、脑卒中和短暂性脑缺血发作等。另外多数患者诉有轻微的认知功能下降。此外,CARASAL患者中非神经系统主诉也较常见,包括口干伴吞咽困难、眼干和肌肉痉挛。体格检查常无殊。
实验室检查一般无明显异常,多用于排除其他疾病。Sanger测序提示NOTCH3、COL4A1、COL4A2、IV3、IV3、HTRA1等其他遗传性SVD相关基因无突变。
影像学表现
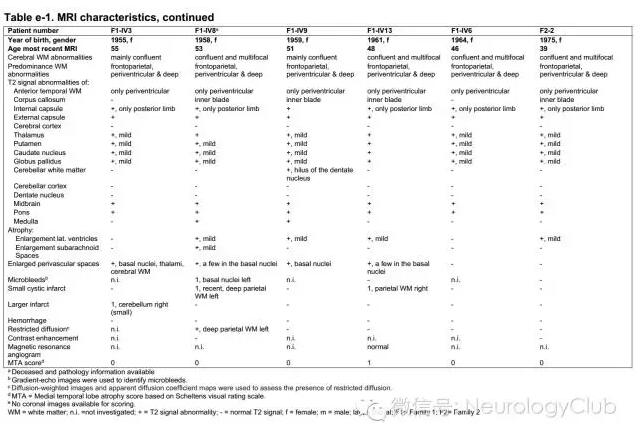
T2/FLARI序列上多表现为脑室旁和深部白质的信号改变,主要位于额顶叶,年轻患者病变呈局灶分布。多不累及颞叶白质和颞极。此外,基底节、丘脑、内囊、外囊和脑干(特别是脑桥和中脑红核)可见小的多灶性信号异常。年长者中病变多融合,分布更广泛。DWI上部分病灶可见弥散受限。另外,随着年纪的增长,脑梗死和脑微出血越显著。
病理学特征
在发现了这类临床表现、MRI具有一定特征性的疾病后,活检病理便是进一步明确的手段。3名患者行脑组织活检,大体可见轻度白质萎缩,另有白质、深部灰质、脑干及小脑内广泛散在分布的小梗死。镜下可见弥漫的白质病变,髓鞘苍白,轴索相对保留,部分髓鞘缺如,胶质增生,少突胶质细胞密度未见减少。脑血管存在严重且广泛的动脉粥样硬化,伴血管壁纤维化和中膜平滑肌细胞缺失。另外,对其中1名患者行全身活检,未发现见于遗传性血管性视网膜病、伴有视网膜病-肾病-卒中的遗传性内皮细胞病等的全身小血管病变。
致病机制
全基因组检测提示CARASAL患者中均存在两种CTSA基因突变,分别是c.973C.T, p.(Arg325Cys) 和c.544G.A, p.(Gly182Arg)。CTSA基因位于染色体20q13区域,编码的是组织蛋白酶A(cathepsin A,CathA)。而CathA是一种羧肽酶,与两种溶酶体酶(半乳糖苷酶和唾液酸苷酶)相关,起到溶酶体稳定作用。CTSA的纯合突变可导致半乳糖唾液酸贮积症(galactosialidosis),这是一种罕见的系统性溶酶体贮积症,在婴儿期就可致命。而CTSA突变导致CARASAL的致病机理目前尚不清楚,可能与溶酶体酶功能异常和内皮素-1(endothelin-1,ET-1)的失活相关。ET-1由CathA降解,在血管收缩和少突胶质细胞前体细胞(Oligodentricyte Progenitor Cells, OPC)的成熟中发挥重要作用。假说认为当CTSA突变,导致CathA活性降低,因此ET-1增多导致血管收缩和脑组织缺氧,从而导致广泛的白质病变和顽固性高血压。
总结
CARASAL是一种罕见的遗传性脑小血管病,因此对于成年起病、有家族史且影像学上存在广泛白质脑病的SVD患者,需先排除NOTCH3,HTRA1和COL4A1/A2突变,并考虑到CARASAL的可能,通过CTSA基因检测有助于确诊。
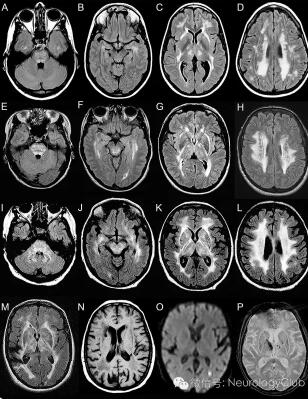
图1:患者F2-2(39岁)(A-D),F1-IV6(46岁)(E-H),F1-III1(67岁)(I-L)和F1-III5(69岁)(M)的轴位MRI图像FLAIR序列;患者F1-III4(73岁)(N)的MRI图像T1序列;患者F1-IV8(53岁)(O)的MRI图像DWI序列;患者F1-III2(P)的MRI图像GRE序列。头颅MRI显示多灶或融合的白质异常,主要分布于额顶叶深部和脑室旁白质(B-D,F-H,J-L),基底节、丘脑、内囊和外囊(C,G,K)。即使年龄小,脑桥也可显示多灶的T2高信号病变(A和E)。白质病变在年长患者中更广泛(比较图A-H和I-L)。患者F1-III5有一个位于右侧额顶叶的大梗死灶(M)。脑室旁白质可见小的囊性梗死灶(N)。有些梗死灶尚处于急性期,DWI高信号(O)且ADC低信号(图未显示)。基底核和丘脑可见微出血和小的出血灶(P)
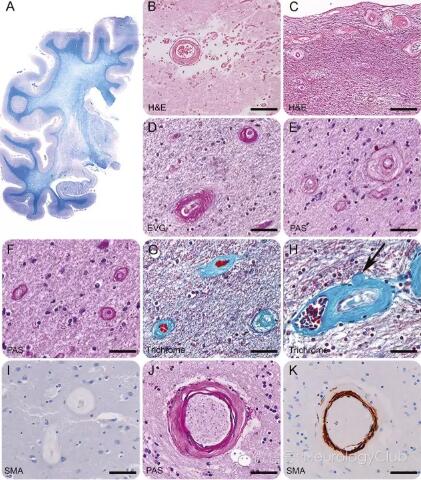
图2:患者F1-III2右侧半球的前海马层面用被用来显示髓鞘的Klüver染色(蓝色)和PAS(紫色)处理,可见广泛的白质苍白,延展至内囊、外囊,偶可累及U形纤维。侧脑室轻微扩大,提示轻度的白质萎缩。皮质和海马不累及(A)。白质缺血灶(B,患者F1-III1) 表现为血管周围组织扩大、稀疏,伴泡沫样巨噬细胞(H&E)。沿侧脑室分布的小动脉表现为不均匀的血管壁纤维增生伴官腔硬化(C,H&E,患者F1-III2)。类似表现还可见于皮质下(D,EVG,患者F1-IV8),深部半球白质(E,PAS,患者F1-III2),纹状体白质纤维束(D,PAS,患者F1-III1)和脑桥(G,Gomori三色染色,患者IV8)。注意还有血管弹性纤维确实(G,Gomori三色染色),PAS阳性物质缺失(E和F,PAS)以及不均匀的小动脉关闭纤维素样增厚(G,Gomori三色染色)。稍大的小动脉的滋养血管(箭头)可被完全堵塞(H,Gomori三色染色, 患者F1-III2)。SMA染色(I,患者F1-IV8)可显示血管平滑肌细胞完全退化。散发的小血管病中(J和K),小动脉提示对称的血管壁增厚,伴向心性胞外基质沉积(J,PAS)和血管平滑肌细胞的较轻的退化(K,SMA)。标尺:(B-C)200μm;(D-K)100μm;EVG=elastic van Gieson;H&E=hematoxylin & eosin;PAS=periodic acid-Schiff;SMA=smooth muscle actin